

普米斯3款抗体新药研究成果在SITC 2022年会发布
- 分类:新闻动态
- 作者:
- 来源:
- 发布时间:2022-11-16
- 访问量:0
【概要描述】 普米斯生物技术公司(以下简称“普米斯”)在近期举行的2022年第37届癌症免疫治疗学会年会(SITC 2022)发布了其自主研发的3款抗体新药的研究成果,其中包括:PM8002(PD-L1 x VEGF)、PM1008(CCR8)和PM1234(HER2 x HER2 x 4-1BB)。
癌症免疫治疗学会(SITC)成立于1984年,是世界领先的致力于推进癌症免疫治疗科学与应用来改善肿瘤患者预后的组织。SITC年会是世界上规模最大的专注于癌症免疫治疗的国际盛会,本届SITC年会于2022年11月8-12日在美国波士顿举行。
普米斯此次公布的创新药研究成果如下:
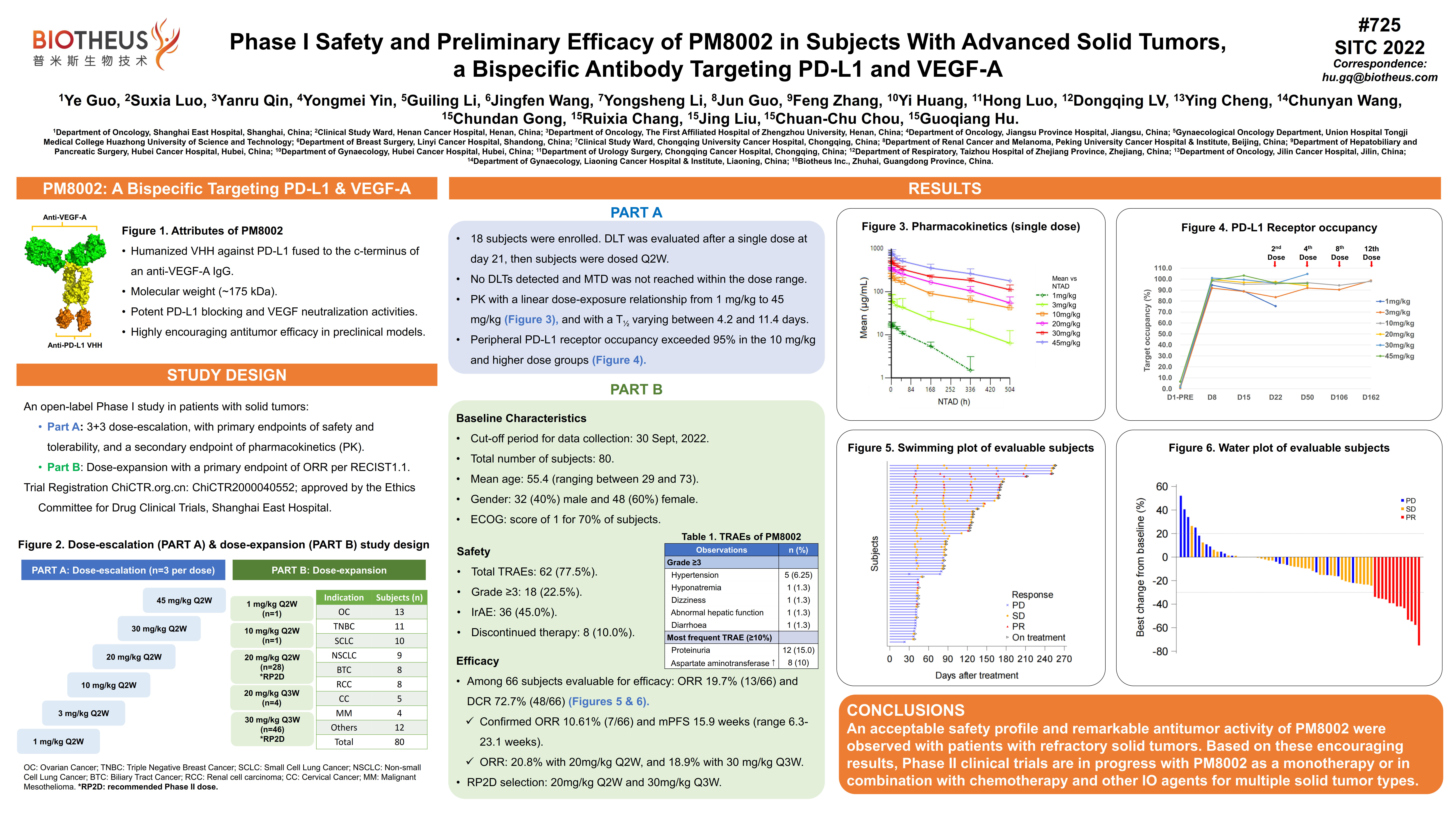
双特异性抗体PM8002(PD-L1 x VEGF):PM8002为同时靶向PD-L1和VEGF的双抗,具有多重抗肿瘤机制,包括结合PD-L1并阻断PD-1/PD-L1相互作用,解除PD-1/PD-L1通路介导的免疫抑制作用,活化细胞毒T淋巴细胞;中和VEGF,抑制血管内皮细胞增殖和新生血管的形成,抑制肿瘤生长,改善肿瘤微环境,提高细胞毒T淋巴细胞在肿瘤微环境中的浸润,与免疫治疗起到协同作用。PM8002现已完成国内I期剂量递增研究,正在针对不同肿瘤开展多项II期临床研究。已有的临床研究结果显示,PM8002的安全性和耐受性良好,对多种晚期肿瘤具有积极的治疗作用,具有较好的开发潜力。
单克隆抗体PM1008(CCR8):调节型T细胞(Treg)作为抑制性免疫细胞,在维持自身免疫平衡中发挥重要作用。但在肿瘤局部富集的Treg细胞可以抑制效应细胞对肿瘤细胞的杀伤,从而促进肿瘤发生发展。特异性清除肿瘤浸润的Treg细胞,同时避免对外周Treg细胞杀伤带来的潜在免疫系统过度激活,是肿瘤免疫治疗的一个重要方向。近年来,随着单细胞测序技术的发展,CCR8被认定为肿瘤浸润的Treg细胞表面特异性表达的标记物。PM1008是经Fc工程改造的全人源抗CCR8单克隆抗体,相较于传统的IgG1野生型单克隆抗体,具有增强的ADCC,ADCP活性。研究结果提示,PM1008具有特异性清除肿瘤浸润Treg细胞的潜力,是极具临床开发价值的新一代靶向Treg细胞的肿瘤免疫治疗分子。
多特异性抗体PM1234(HER2 x HER2 x 4-1BB):PM1234是一款同时靶向HER2双表位以及T细胞共刺激受体4-1BB的多特异性抗体。PM1234采用公司特有的1+1非对称结构,同时结合HER2的ECD2以及ECD4表位,从而使得PM1234能够在HER2表达的细胞中更强地诱导4-1BB交联激活T细胞,以及更有效地阻断HER2信号诱导的肿瘤细胞增殖。PM1234采用了野生型IgG1 Fc,从而保持了对于HER2细胞的ADCC/ADCP效应。另外,PM1234结合4-1BB靠近胞膜端的CRD4结构域,实验证明PM1234不会通过Fc受体介导对4-1BB阳性T细胞的杀伤,或者介导4-1BB交联产生非HER2依赖性T细胞激活。在临床前研究中,PM1234表现出优于同类HER2靶向药物的药效(包括ADC药物,单抗联合治疗,4-1BB双抗等), 特别是其表现出的优异的免疫记忆效应,PM1234可以通过激活HER2阳性肿瘤中的肿瘤特异性T细胞达到对于远端HER2阴性肿瘤细胞的杀伤和抑制。
关于普米斯
普米斯于2018年注册成立,一直秉承“点亮创新火种,成就健康人生”的创业使命,聚焦恶性肿瘤及自身免疫疾病,致力于国家一类创新生物药的研发及产业化。普米斯核心研发团队具有务实的国内外创新生物药研发、药政策略、产业化和商业化经验,正在推进超过20个1类生物新药项目,现有10个新药项目处于临床研究阶段。普米斯在珠海、苏州和香港均设有新药研发中心,在上海、北京设立临床研究中心,并在南通建设产业化生产基地,未来普米斯将凭借其高价值的产品链、强大的创新能力、经验丰富的核心团队迅速跻身国内生物制药企业第一梯队。
普米斯3款抗体新药研究成果在SITC 2022年会发布
【概要描述】 普米斯生物技术公司(以下简称“普米斯”)在近期举行的2022年第37届癌症免疫治疗学会年会(SITC 2022)发布了其自主研发的3款抗体新药的研究成果,其中包括:PM8002(PD-L1 x VEGF)、PM1008(CCR8)和PM1234(HER2 x HER2 x 4-1BB)。
癌症免疫治疗学会(SITC)成立于1984年,是世界领先的致力于推进癌症免疫治疗科学与应用来改善肿瘤患者预后的组织。SITC年会是世界上规模最大的专注于癌症免疫治疗的国际盛会,本届SITC年会于2022年11月8-12日在美国波士顿举行。
普米斯此次公布的创新药研究成果如下:
双特异性抗体PM8002(PD-L1 x VEGF):PM8002为同时靶向PD-L1和VEGF的双抗,具有多重抗肿瘤机制,包括结合PD-L1并阻断PD-1/PD-L1相互作用,解除PD-1/PD-L1通路介导的免疫抑制作用,活化细胞毒T淋巴细胞;中和VEGF,抑制血管内皮细胞增殖和新生血管的形成,抑制肿瘤生长,改善肿瘤微环境,提高细胞毒T淋巴细胞在肿瘤微环境中的浸润,与免疫治疗起到协同作用。PM8002现已完成国内I期剂量递增研究,正在针对不同肿瘤开展多项II期临床研究。已有的临床研究结果显示,PM8002的安全性和耐受性良好,对多种晚期肿瘤具有积极的治疗作用,具有较好的开发潜力。
单克隆抗体PM1008(CCR8):调节型T细胞(Treg)作为抑制性免疫细胞,在维持自身免疫平衡中发挥重要作用。但在肿瘤局部富集的Treg细胞可以抑制效应细胞对肿瘤细胞的杀伤,从而促进肿瘤发生发展。特异性清除肿瘤浸润的Treg细胞,同时避免对外周Treg细胞杀伤带来的潜在免疫系统过度激活,是肿瘤免疫治疗的一个重要方向。近年来,随着单细胞测序技术的发展,CCR8被认定为肿瘤浸润的Treg细胞表面特异性表达的标记物。PM1008是经Fc工程改造的全人源抗CCR8单克隆抗体,相较于传统的IgG1野生型单克隆抗体,具有增强的ADCC,ADCP活性。研究结果提示,PM1008具有特异性清除肿瘤浸润Treg细胞的潜力,是极具临床开发价值的新一代靶向Treg细胞的肿瘤免疫治疗分子。
多特异性抗体PM1234(HER2 x HER2 x 4-1BB):PM1234是一款同时靶向HER2双表位以及T细胞共刺激受体4-1BB的多特异性抗体。PM1234采用公司特有的1+1非对称结构,同时结合HER2的ECD2以及ECD4表位,从而使得PM1234能够在HER2表达的细胞中更强地诱导4-1BB交联激活T细胞,以及更有效地阻断HER2信号诱导的肿瘤细胞增殖。PM1234采用了野生型IgG1 Fc,从而保持了对于HER2细胞的ADCC/ADCP效应。另外,PM1234结合4-1BB靠近胞膜端的CRD4结构域,实验证明PM1234不会通过Fc受体介导对4-1BB阳性T细胞的杀伤,或者介导4-1BB交联产生非HER2依赖性T细胞激活。在临床前研究中,PM1234表现出优于同类HER2靶向药物的药效(包括ADC药物,单抗联合治疗,4-1BB双抗等), 特别是其表现出的优异的免疫记忆效应,PM1234可以通过激活HER2阳性肿瘤中的肿瘤特异性T细胞达到对于远端HER2阴性肿瘤细胞的杀伤和抑制。
关于普米斯
普米斯于2018年注册成立,一直秉承“点亮创新火种,成就健康人生”的创业使命,聚焦恶性肿瘤及自身免疫疾病,致力于国家一类创新生物药的研发及产业化。普米斯核心研发团队具有务实的国内外创新生物药研发、药政策略、产业化和商业化经验,正在推进超过20个1类生物新药项目,现有10个新药项目处于临床研究阶段。普米斯在珠海、苏州和香港均设有新药研发中心,在上海、北京设立临床研究中心,并在南通建设产业化生产基地,未来普米斯将凭借其高价值的产品链、强大的创新能力、经验丰富的核心团队迅速跻身国内生物制药企业第一梯队。
- 分类:新闻动态
- 作者:
- 来源:
- 发布时间:2022-11-16
- 访问量:0
普米斯生物技术公司(以下简称“普米斯”)在近期举行的2022年第37届癌症免疫治疗学会年会(SITC 2022)发布了其自主研发的3款抗体新药的研究成果,其中包括:PM8002(PD-L1 x VEGF)、PM1008(CCR8)和PM1234(HER2 x HER2 x 4-1BB)。
癌症免疫治疗学会(SITC)成立于1984年,是世界领先的致力于推进癌症免疫治疗科学与应用来改善肿瘤患者预后的组织。SITC年会是世界上规模最大的专注于癌症免疫治疗的国际盛会,本届SITC年会于2022年11月8-12日在美国波士顿举行。
普米斯此次公布的创新药研究成果如下:
双特异性抗体PM8002(PD-L1 x VEGF):PM8002为同时靶向PD-L1和VEGF的双抗,具有多重抗肿瘤机制,包括结合PD-L1并阻断PD-1/PD-L1相互作用,解除PD-1/PD-L1通路介导的免疫抑制作用,活化细胞毒T淋巴细胞;中和VEGF,抑制血管内皮细胞增殖和新生血管的形成,抑制肿瘤生长,改善肿瘤微环境,提高细胞毒T淋巴细胞在肿瘤微环境中的浸润,与免疫治疗起到协同作用。PM8002现已完成国内I期剂量递增研究,正在针对不同肿瘤开展多项II期临床研究。已有的临床研究结果显示,PM8002的安全性和耐受性良好,对多种晚期肿瘤具有积极的治疗作用,具有较好的开发潜力。
单克隆抗体PM1008(CCR8):调节型T细胞(Treg)作为抑制性免疫细胞,在维持自身免疫平衡中发挥重要作用。但在肿瘤局部富集的Treg细胞可以抑制效应细胞对肿瘤细胞的杀伤,从而促进肿瘤发生发展。特异性清除肿瘤浸润的Treg细胞,同时避免对外周Treg细胞杀伤带来的潜在免疫系统过度激活,是肿瘤免疫治疗的一个重要方向。近年来,随着单细胞测序技术的发展,CCR8被认定为肿瘤浸润的Treg细胞表面特异性表达的标记物。PM1008是经Fc工程改造的全人源抗CCR8单克隆抗体,相较于传统的IgG1野生型单克隆抗体,具有增强的ADCC,ADCP活性。研究结果提示,PM1008具有特异性清除肿瘤浸润Treg细胞的潜力,是极具临床开发价值的新一代靶向Treg细胞的肿瘤免疫治疗分子。

多特异性抗体PM1234(HER2 x HER2 x 4-1BB):PM1234是一款同时靶向HER2双表位以及T细胞共刺激受体4-1BB的多特异性抗体。PM1234采用公司特有的1+1非对称结构,同时结合HER2的ECD2以及ECD4表位,从而使得PM1234能够在HER2表达的细胞中更强地诱导4-1BB交联激活T细胞,以及更有效地阻断HER2信号诱导的肿瘤细胞增殖。PM1234采用了野生型IgG1 Fc,从而保持了对于HER2细胞的ADCC/ADCP效应。另外,PM1234结合4-1BB靠近胞膜端的CRD4结构域,实验证明PM1234不会通过Fc受体介导对4-1BB阳性T细胞的杀伤,或者介导4-1BB交联产生非HER2依赖性T细胞激活。在临床前研究中,PM1234表现出优于同类HER2靶向药物的药效(包括ADC药物,单抗联合治疗,4-1BB双抗等), 特别是其表现出的优异的免疫记忆效应,PM1234可以通过激活HER2阳性肿瘤中的肿瘤特异性T细胞达到对于远端HER2阴性肿瘤细胞的杀伤和抑制。

关于普米斯
普米斯于2018年注册成立,一直秉承“点亮创新火种,成就健康人生”的创业使命,聚焦恶性肿瘤及自身免疫疾病,致力于国家一类创新生物药的研发及产业化。普米斯核心研发团队具有务实的国内外创新生物药研发、药政策略、产业化和商业化经验,正在推进超过20个1类生物新药项目,现有10个新药项目处于临床研究阶段。普米斯在珠海、苏州和香港均设有新药研发中心,在上海、北京设立临床研究中心,并在南通建设产业化生产基地,未来普米斯将凭借其高价值的产品链、强大的创新能力、经验丰富的核心团队迅速跻身国内生物制药企业第一梯队。
扫二维码用手机看
推荐阅读
- 普米斯宣布与翰森制药就扩大开发EGFR/cMet双特异性抗体药物达成战略合作 2024.03.14
- 普米斯宣布PM8002(抗PD-L1/VEGF双抗)成功纳入“突破性治疗品种名单” 2024.03.09
- 普米斯宣布与Bitterroot Bio达成战略合作 2024.02.27
- SABCS 2023 | 普米斯公布双特异性抗体PM8002联合白蛋白紫杉醇一线治疗晚期三阴性乳腺癌的最新临床进展 2023.12.13
- 普米斯宣布与BioNTech(百欧恩泰)达成战略合作 2023.11.06
- SITC 2023│普米斯公布2款双特异性抗体最新研究成果 2023.11.04



